Welche chemischen Reaktionen in der Stratosphäre führen zum Ozonabbau?
Chemie
Die Bildung von Ozon erfolgt nach einem einfachen Schema:
O2 (mit UV-Licht) --> 2 O
O2 + O --> O3
O, ein Sauerstoffatom, ist ein sogenanntes Radikal. Radikale sind meist sehr reaktionsfreudig.
Die Zerstörung von Ozon erfolgt ebenfalls durch Radikale, beispielhaft sei die Reaktion genannt:
Cl + O3 --> ClO + O2
ClO + O --> Cl + O2
Netto: O3 + O --> 2 O2
Hier werden die Radikale Cl (Chlor) und ClO (Chloroxid) nicht verbraucht, und können in dieser sogenannten katalytischen Reaktion stets von neuem reagieren. Mit Br (Brom) verläuft die Reaktion analog.
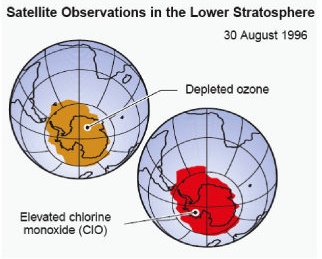
Der Gehalt der reaktiven Spezies Cl, Br, ClO, BrO in der Stratosphäre bestimmt (unter anderem) die Abbaugeschwindigkeit des Ozons. Beispielsweise hatte man bei den Vermessungen des antarktischen Ozonlochs eine räumliche direkte Korrelation zwischen Ozonmangel und ClO-Gehalt gemessen.
|
|
|
Quelle: World Meteorological Organization 2006, http://www.wmo.int/pages/prog/arep/gaw/ozone_2006/ozone_asst_report.html |
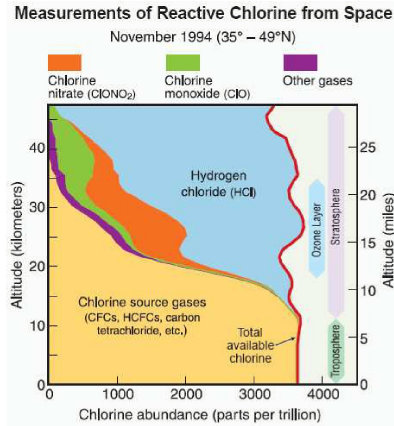
Die reaktiven Spezies bilden sich innerhalb der Stratosphäre durch Spaltung aus den sogenannten Reservoir-Spezies, hauptsächlich HCl (gasförmige Salzsäure) und ClONO2 (Chlornitrat), welche wiederum aus den originalen gasförmigen Chlorverbindungen durch UV-induzierte Reaktionen erzeugt werden. Die Originalverbindungen - z. B. FCKW und HFCKW - sind so stabil, dass sie über Jahre den Aufstieg vom Erdboden über die Troposphäre bis in die Stratosphäre (ca. 25 km Höhe) schaffen; erst dort werden sie durch das in dieser Höhe stärkere UV-Licht zersetzt.
Für Bromverbindungen gilt Analoges.
Die Abbildung zeigt die Verteilung der Chlor-Spezies über die Höhe. Man erkennt (rote Linie), dass der Gesamtgehalt an Chlor über die gesamte Höhe von ca. 40 km nahezu konstant ist, ca.3500 ppt (10 hoch minus 12).
In der Stratosphäre sind HCl (blau) und Chlornitrat (orange) die vorherrschende Spezies.
Wodurch bildet sich im Frühjahr an den Polarregionen, am Südpol deutlich ausgeprägter als am Nordpol, ein besonders starkes "Ozonloch"?
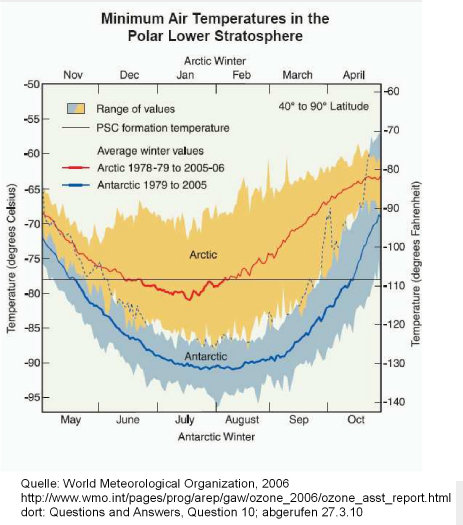
Dies hängt mit den sogenannten polaren Stratosphärenwolken (engl. PSC, polar stratospheric clouds) zusammen, die sich unterhalb ca. minus 78 Grad Celsius bilden.
Die Abbildung zeigt die Lufttemperaturen in den Polregionen in den Wintermonaten (blaue Kurve: Antarktis, rote Kurve: Arktis).
Wegen der Landmasse der Antarktis ist es dort kälter, und PSC können sich während vier Monaten (Juni bis September) bilden (Quelle)
Diese Wolken bestehen, stark vereinfacht, aus Salpetersäure-Eis-Mischungen, an deren Oberfläche Reaktionen katalysiert werden, von denen einige unten gezeigt sind:

Die Reaktionen A und B erzeugen aus den Reservoir-Spezies reaktive Spezies (Cl2 lässt sich leicht zu 2 Cl spalten).
Die Reaktionen C bis E entziehen der Atmosphäre Stickoxide unter Bildung von HNO3 (Salpetersäure, die in der PSC auskristallisiert). Diese Stickoxide sind Radikalfänger und stehen für den Einfang der reaktiven Spezies dann nicht mehr zur Verfügung.
Im Frühjahr, wenn das erste Sonnenlicht diese Wolken erreicht, ist ein erhöhter Gehalt an reaktiven Spezies vorhanden, gleichzeitig ein geringer Gehalt an Radikalfängern, sodass Ozon mit hoher Geschwindigkeit abgebaut wird. Die Aufbaureaktion für Ozon (siehe Anfang dieser Seite) benötigt stärkere UV-Strahlung und kann noch nicht stattfinden.
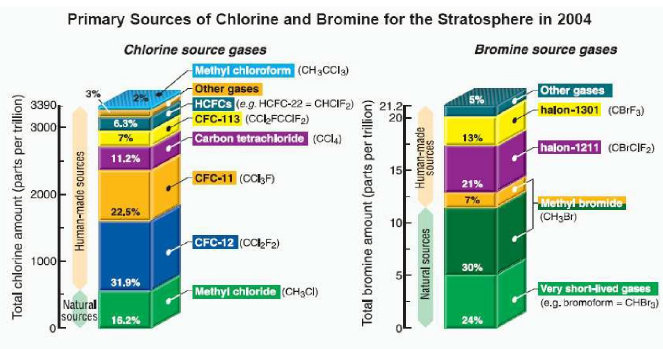
Welches sind nun die Originalverbindungen, die zum Chlor- bzw. Bromgehalt der Stratosphäre führen? Die Graphik unten zeigt für das Jahr 2004 die wichtigsten Chlorverbindungen, darunter die FCKW CCl2F2 undCCl3F, sowie bei den Bromverbindungen Methylbromid (CH3Br) und die Halone CBrClF2 und CBrF3. Man beachte die unterschiedliche Skala der beiden Säulen.
Quelle: WMO wie oben, Question 7; abgerufen 27.3.2010
Die Menge allein entscheidet nicht über die Wirkung, sie muss mit dem Ozonzerstörungspotenzial (engl. ODP, Ozone Depletion Potential) multipliziert werden. Dieses hängt einerseits davon ab, wie stabil die Verbindung in der Atmosphäre ist, d. h. wie wahrscheinlich ein Molekül in die Stratosphäre gelangt, und andererseits von dessen katalytischen Aktivität, d. h. der durchschnittlichen Anzahl an Reaktionen vor der Abbruchreaktion.
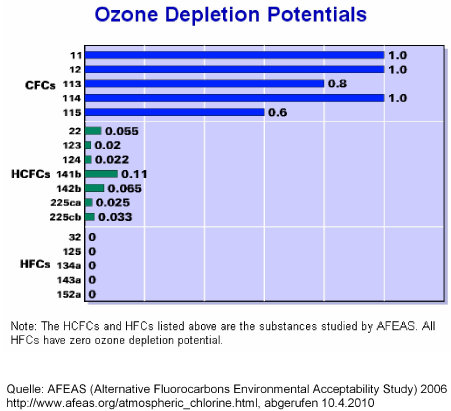
Für Chlorverbindungen zeigt die Graphik rechts, dass die wichtigsten FCKW (engl. CFC) mit einem ODP=1 bewertet werden (Normierung). HFCKW liegen bei ca. 0,02, da sie sich schneller zersetzen. HFKW haben ein ODP=0, da sie kein Chlor enthalten (Quelle).
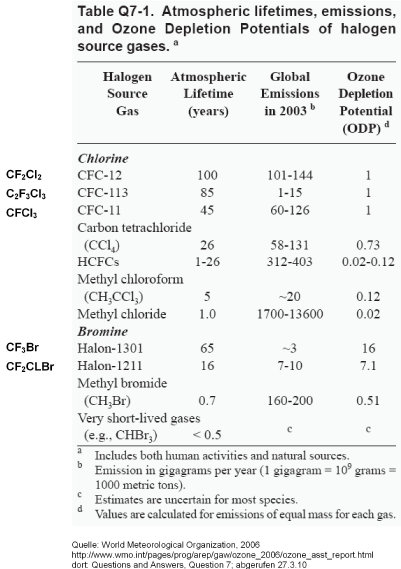 Für Chlor- und Bromverbindungen zeigt die Tabelle links die Lebenszeit in der Atmosphäre, die mehrere Jahrzehnte betragen kann, sowie das ODP.
Für Chlor- und Bromverbindungen zeigt die Tabelle links die Lebenszeit in der Atmosphäre, die mehrere Jahrzehnte betragen kann, sowie das ODP.
Brom hat eine erheblich höhere katalytische Aktivität als Chlor, was man aus dem ODP=16 von CF3Br ablesen kann, das eine vergleichbare Lebensdauer hat wie die FCKW mit ODP=1.
Wie Politik und Wirtschaft diese wissenschaftlichen Erkenntnisse umsetzten, siehe politischer Problemlösungsprozess.